Экстракорпоральное оплодотворение (оплодотворение вне тела, от латинского extra-внешний и corpus-тело) -это вспомогательная репродуктивная технология, которая в настоящее время является основным методом лечения женского бесплодия.
Суть технологии ЭКО заключается в том что, зрелые яйцеклетки, полученные путем стимуляции гонадотропными препаратами, извлекают из организма женщины, помещают в пробирку со специальным раствором и оплодотворяют с помощью предварительно подготовленной спермы.
Оплодотворенную яйцеклетку (эмбрион) инкубируют в течение нескольких дней в специалной среде, в предусмотренных технологией условиях, после чего возвращают в полость матки для дальнейшего развития.
Успешный исход ЭКО составляет около 35%, что считается достаточно эффективным показателем лечения бесплодия.
Сама по себе, процедура ЭКО не представляет опасности для здоровья пациентки и при неблагоприятном исходе может быть предпринята повторная попытка. В литературе описаны случаи когда беременность наступала после 8-10 попытки.
Впервые применение технологии ЭКО завершилось успешными родами в 1978 году в Великобритании. В 1990 году в мире насчитывалось около 20 тысяч детей, зачатых с помощью ЭКО. В 2010 году их число уже превышало 20 миллионов.
Успех процедуры ЭКО зависит от правильной оценки степени полноценности функционального состояния репродуктивной системы пациентки. Критерием достоверности этой оценки является способность яичников к индукции созревания достаточного количества адекватных фолликулов в ответ на стимуляцию гонадотропинами.
Подобная реакция яичника отражает так называемый «овариальный резерв», представляющий из себя запас примордиальных фолликулов, который формируется при внутриутробном развитии плода и достигает максимума (около 7 миллионов) к 16-20 неделе гестации.
В дальнейшем до момента рождения, вследствие включения механизма аппоптоза (механизм самоликвидации клеток), происходит сокращение количества примордиальных фолликулов до 1-2 миллионов.
По достижении репродуктивного возраста количество таких фолликулов сокращается до 250-300 тысяч. Это то максимальное количество фолликулов, которое природа предусмoтрела для реализации женщиной ее репродуктивной функции.
В репродуктивный период процесс истощения фолликулярного запаса продолжается, усиливаясь с возрастом. По достижении 37-39 лет в яичниках остается всего около 25 тысяч фолликулов, а к перименопаузе всего около 1 тысячи.
От момента достижения половозрелости до наступления менопаузы овулируют лишь 300-400 фолликулов.
В течение всего репродуктивного периода в каждом менструальном цикле под влиянием ФСГ начинает созревать около 10 фолликулов. К окончанию первой недели от начала менструального цикла формируется доминантный фолликул, с развитием которого продолжается развитие яйцеклетки. Остальные фолликулы, отстающие в своем развитии, погибают в результате артрезии (дегенеративная регрессия).
Созревание доминантной фолликулы и, соответственно, созревание яйцеклетки в среднем продолжается еще неделю. В этот период яичник интенсивно продуцирует эстрогены — женские половые гормоны.
За день до овуляции уровень эстрогенов резко возрастает, что вызывает секрецию лютеинизирующего гормона. В результате доминантный фолликул разрывается, высвобождая готовую к оплодотворению яйцеклетку (фаза овуляции).
Одной из основных причин бесплодия женщин репродуктивного возраста является преждевременное истощение овариального резерва, которое может быть вызвано недостаточной закладкой фолликулярного пула в период внутриутробного развития или повышенной скоростью артрезии в репродуктивный период. Истощению овариального резерва также могут способствовать генетические, инфекционно-токсические, аутоиммунные и ятрогенные факторы.
В последние годы, в связи с развитием диагностических технологий, для повышения степени достоверности оценки «овариального резерва» и вероятности успеха ЭКО, наряду с сонографическими параметрами, широко применяются так называемые гормональные маркеры овариального резерва.
ОВАРИАЛЬНЫЙ РЕЗЕРВ И МЕТОДЫ ЕГО ОЦЕНКИ
Овариальный резерв — это запас фолликулов способных к развитию и продуцированию готовой к оплодотворению яйцеклетки.
Оценка овариального резерва женщин репродуктивного возраста с диагнозом — бесплодие является необходимым условием для выбора адекватного метода и тактики лечения.
При пониженном овариальном резерве длительное обследование и лечение в ряде случаев может быть противопоказанным поставленной цели поскольку, с течением времени истощение овариального резерва пациентки может достигнуть уровня, при котором вероятность наступления беременности становится крайне низкой. В подобных случаях шанс наступления беременности значительно возрастает при лечении с применением тахнологии ЭКО. В этом варианте оценка овариального резерва необходима для выработки наиболее эффективной схемы стимуляции яичников с целью повышения шанса наступления беременности.
Оценка овариального резерва производится на основе совместного анализа сонографических параметров (объем яичников, количество антральных фолликулов) и гормональных маркеров овариального резерва (АМГ, Ингибин В, ФСГ и др.).
Ориентировочные значения сонографических параметров и концентраций гормональных маркеров в сыворотке крови, характерные для пациенток с высоким и низким овариальным резервом.
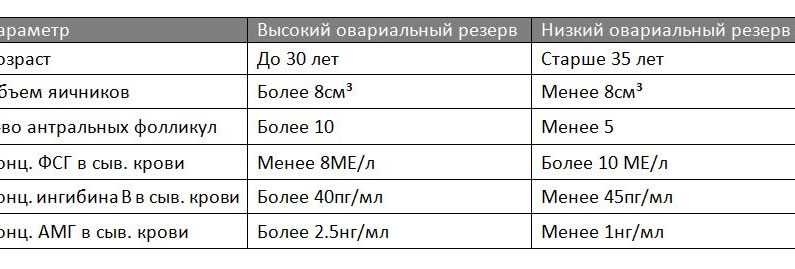
Пациенткам с высоким овариальным резервом для стимуляции роста и развития фолликулов требуются низкие дозы гонадотропинов. Следует иметь ввиду, что у этих пациенток (пациентки с «хорошим ответом» на стимуляцию) высока вероятность множественного роста фолликулов (синдром гиперстимуляции яичников) если доза препарата гонадотропина окажется завышеной.
Пациенткам с низким овариальном резервом (пациентки с «бедным ответом» на стимуляцию) для индукции и роста фолликулов требуются гораздо большие дозы гонадотропина поскольку у них вероятность наступления беременности существенно ниже чем у пациенток с «хорошим ответом» на стимуляцию. Вместе с тем, у пациенток с «бедным ответом» позитивным является то что, у них вряд ли возможно развитие синдрома гиперстимуляции яичников.
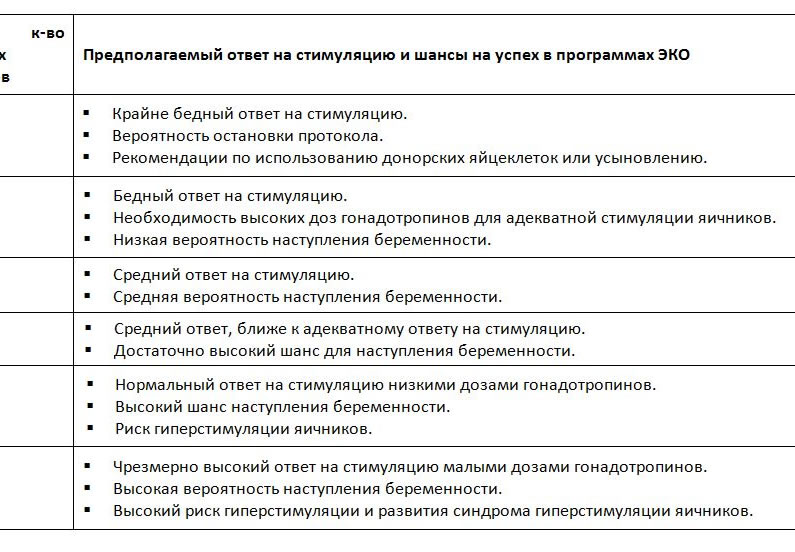
Оценка шанса наступления беременности в зависимости от количества антральных фолликулов определенных сонографическим методом.
ГОРМОНАЛЬНЫЕ МАРКЕРЫ ОВАРИАЛЬНОГО РЕЗЕРВА
Фолликулостимулирующий гормон (ФСГ). ФСГ секретируется передней долей гипофиза в количествах, необходимых для индуцирования процесса созревания фолликулов. Концентрация ФСГ в сыворотке крови женщин репродуктивного возраста является цикл-зависимой величиной. Определение его концентрации как правило проводится на 3 день менструального цикла.
Для женщин с высоким «овариальным резервом» величина этого показателя составляет 8-10МЕ/л и его повышение на 20-30% указывает на вероятное снижение «овариального резерва» за несколько лет до наступления менопаузы. Надежность прогностической значимости этого показателя ограничена тем, что в период пременопаузы результаты определения концентрации ФСГ в разных циклах варьируют в пределах ±20% от среднеарифметического значения определений в 6 циклах.
Эстрадиол (Е2). Повышенные уровни эстрадиола, при нормальных значениях концентрации ФСГ, могут служить показателем сниженного овариального резерва. Низкий уровень эстрадиола (менее 80пг/мл) на 3 день менструального цикла, наряду с нормальной концентрацией ФСГ, у женщин в возрасте 38-42 лет скорее всего свидетельствует о благоприятном прогнозе. Тестирование эстрадиола в дополнение к тестированию ФСГ позволяет предсказать потенциальную фертилизацию с большей степенью вероятности по сравнению с определением только концентрации ФСГ или Эстрадиола.
Ингибин В (фолликулостатин). Ингибин В димерный гликопротеин, относящийся к семейству трансформирующих факторов роста, синтезируется в гранулезных клетках растущих антральных фолликулов. Он подавляет секрецию ФСГ по механизму отрицательной обратной связи и принимает участие в регуляции уровня ФСГ в раннем и среднем периоде фолликулиновой фазы.
При нормальном менструальном цикле, в ранюю фолликулярную фазу (2-3 день цикла), на фоне минимальных концентрацийФСГ (не более 10МЕ/мл), концентрация Ингибина В в сыворотке крови достигает максимума в диапазоне значений 40-100пг/мл.
С возрастом интенсивность синтеза Ингибина В понижается и в постменопаузе его концентрация в сыворотке крови не превышает 5нг/мл. Более высокие концентрации этого гормона в постменопаузе требуют исключения гранулезной или муцинозной карциномы яичников, для которых Ингибин В является специфическим маркером. При указанных новообразованиях его уровень может повысится до 300нг/мл. Определение концентрации Ингибина В совместно с другими методами исследования позволяют идентифицировать опухоль и контролировать процесс лечения.
Концентрация Ингибина В в сыворотке крови, определенная на 3 день менструального цикла пропорционально отражает количество антральных фолликулов, поэтому Ингибин В часто используют в качестве маркера «овариалного резерва» в процедуре ЭКО. Однако, поскольку секреция Ингибина В происходит по механизму отрицательной обратной связи с секрецией ФСГ, его прогностическая значимость в качестве маркера несущественно отличается от таковой для ФСГ. В частности было показано что, при успешном ЭКО (38 пациенток) среднеарифметическое значение концентрации Ингибина В практически не отличалось от аналогичного параметра для 71 пациентки с безуспешным завершением цикла ЭКО.
Антимюллеров гормон (АМГ). АМГ является димерным гликопротеином, который также как и Ингибин В относится к семейству трансформирующих факторов роста. У женщин продуцируется гранулезными клетками яичника, начиная с момента рождения и прекращается с наступлением менопаузы. По достижении совершеннолетия концентрация АМГ в сыворотке крови в норме составляет от 1 до 2.5нг/мл.
Концентрация АМГ в сыворотке крови строго коррелирует с количеством антральных фолликулов и отражает «овариальный резерв» женщин репродуктивного возраста. Наиболее эффективнoАМГ продуцируется в преантральных и малых антральных фолликулах (размер менее 4мм в диаметре). По мере увеличения размеров фолликул выроботка АМГ постепенно сокращается и прекращается в фолликулах диаметром более 8мм. Поскольку количество зрелых фолликул в каждом менструальном цикле мало по сравнению с общим количеством фолликулов вырабатывающих АМГ, концентрация последнего в циркулирующей крови практически не зависит от фазы менструального цикла.
Результаты специальных исследований, посвященных оценке эффективности гормональных маркеров «овариального резерва», позволили заключить, что АМГ является наиболее надежным и точным маркером овариального ответа на стимуляцию гонадотропинами, по сравнению с ФСГ и Ингибином В.
В частности, было показано что при одновременном определении концентраций АМГ, ФСГ и Ингибина В в сыворотке крови на 3 день цикла, АМГ оказался единственным гормоном, имеющим достоверную значимость при прогнозировании клинической беременности в протоколах ЭКО пациенток до 42 лет. При клинической беременности (38 пациенток) среднеарифметическое значение концентрации АМГ в сыворотке крови составляло 2.4нг/мл а в случее безуспешного цикла ЭКО (71 пациенток) — 1.1нг/мл. При этом, значения концентраций Ингибина В и ФСГ для этих двух групп женщин с диаметрально противоположными функциональными возможностями яичников практически не имели статистически значимых различий.
Анологичные результаты были получены при обследовании 25 пациенток репродуктивного возраста с диагнозом женское бесплодие, которые были разделены на две группы:
1 группа — 17 пациенток (возраст 25-28 лет) с достаточным ответом на стимуляцию препаратами гонадотропина, 2 группа — 8 пациенток (возраст 32-36 лет) с низким ответом на стимуляцию. Результаты исследований показали что уровни ФСГ иИнгибина В измеренные на 3 день менструального цикла для обоих групп пациенток практически не различались. Принципальные различия были обнаружены лишь при сравнении концентраций АМГ. Среди 17 пациенток 1 группы, значения концентраций АМГ варьировали в диапазоне 2.98-5.89нг/мл, в то время как, среднеарифметическое значение этого же показателя у пациенток 2 группы составляло 0.94нг/мл.
В результате гонадотропиновой индукции овуляции исходом лечения среди пациенток 1 группы явилось наступление беременности в 5 случаях (29.5%), а среди пациенток 2 группы в
1 случае (12.5%).





